NITROGEN DAN OKSIGEN
1. Nitrogen
Nitrogen (Latin nitrum, Bahasa Yunani Nitron berarti “soda asli”, “gen”, “pembentukan”) secara resmi ditemukan oleh Daniel Rutherford pada 1772, yang menyebutnya udara beracun atau udara tetap. Pengetahuan bahwa terdapat pecahan udara yang tidak membantu dalam pembakaran telah diketahui oleh ahli kimia sejak akhir abad ke-18 lagi. Nitrogen juga dikaji pada masa yang lebih kurang sama oleh Carl Wilhelm Scheele, Henry Cavendish, dan Joseph Priestley, yang menyebutnya sebagai udara terbakar atau udara telah flogistat. Gas nitrogen adalah cukup lemas sehingga dinamakan oleh Antoine Lavoisier sebagai azote, daripada perkataan Yunani αζωτος yang bermaksud “tak bernyawa”. Istilah tersebut telah menjadi nama kepada nitrogen dalam perkataan Perancis dan kemudiannya berkembang ke bahasa-bahasa lain.
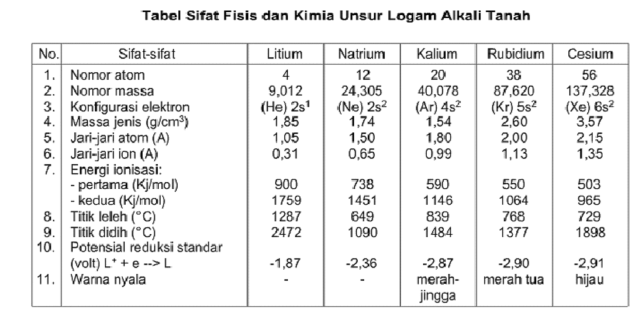
Nitrogen adalah salah satu unsur golongan VA yang merupakan unsur nonlogam dan gas yang paling banyak di atmosfer bumi. Nitrogen merupakan unsur yang relatif stabil, tetapi membentuk isotop-isotop yang 4 di antaranya bersifat radioaktif. Di alam nitrogen terdapat dalam bentuk gas N2 yang tidak berwarna dan tidak berbau, tidak berasa, dan tidak beracun. Pada suhu yang rendah nitrogen dapat berbentuk cairan atau bahkan kristal padat yang tidak berwarna (bening). Selain itu nitrogen terdapat dalam bentuk senyawa nitrat, amoniak, protein dan beberapa (Sunardi, 2006: 61-62).
Nitrogen merupakan molekul diatomik yang memiliki ikatan rangkap tiga.3 Energi ikatannya cukup tinggi sehingga sangat stabil dan sulit bereaksi. Karena itu kebanyakan entalpi dan energi bebas pembentukan senyawa nitrogen bertanda positif. Molekul nitrogen ini sangat ringan dan nonpolar sehingga gaya van der waals antar molekul sangat kecil. Gas ini masuk dan keluar tubuh manusia sewaktu bernafas tanpa berubah. Gas ini tidak berbau dan tidak berasa. Nitrogen sangat diperlukan digunakan sebagai pembuatan senyawa penting seperti amonia dan urea. Karena kesetabilan yang tinggi, nitrogen dipakai untuk gas pelindung gas oksigen dalam pabrik kimia, industri logam, dan dalam pembuatan komponen elektronika. Nitrogen cair juga di gunakan untuk membekukan makanan secara cepat (Syukri, 1999: 579).
Nitrogen atau zat lemas adalah sebuah unsur kimia dalam tabel periodik yang memiliki lambang N dan nomor atom 7. Biasanya ditemukan sebagai gas tanpa warna, tanpa bau, tanpa rasa dan merupakan gas diatomik bukan logam yang stabil, sangat sulit bereaksi dengan unsur atau senyawa lainnya. Dinamakan zat lemas karena zat ini bersifat malas, tidak aktif bereaksi dengan unsur lainnya.
Nitrogen terdapat di udara kira-kira 78,09% persen dari atmosfir bumi dan terdapat dalam banyak jaringan hidup. Zat lemas membentuk banyak senyawa penting seperti asam amino, amoniak, asam nitrat, dan sianida. Nitrogen adalah zat non logam, dengan elektronegatifitas 3.0. Mempunyai 5 elektron di kulit terluarnya. Oleh karena itu trivalen dalam sebagian besar senyawa. Nitrogen mengembun pada suhu 77K (-196oC) pada tekanan atmosfir dan membeku pada suhu 63K (-210oC).
Nitrogen dapat ditemukan di alam :
o Nitrogen terdapat di alam sebagai unsur bebas berupa molekul diatomik (N2) kira-kira 78,09% volume atmosfir.
o Dijumpai dalam mineral penting seperti (KNO3) dan sendawa Chili (NaNO3).
o Pada tumbuhuan dan hewan, nitrogen berupa bentuk protein yang komposisi rata-ratanya 51% C; 25% O; 16% N; 7% H; 0,4%P; dan 0,4% S.
SIFAT KIMIA NITROGEN
Nitrogen adalah unsur yang unik dalam golongannya, karena dapat membentuk senyawa dalam semua bilangan oksidasi dari tiga sampai lima. Senyawa nitrogen dapat mengalami reaksi reduksi dan oksidasi. Adapun sifat kimia nitrogen antara lain seperti berikut.
Sukar bereaksi dengan unsur lain kecuali dengan unsur unsur logam reaktif membentuk nitrida ionik :
6Li(s) + N2(g) à 2Li3N(s)
Catatan : dengan Mg dan Sr membentuk nitrida ionik pada suhu tinggi
CARA MEMPEROLEH NITROGEN
1. Skala Laboratorium : memanaskan larutan yang mengandung garam amonia dan garam nitrit.
NH4+(aq) + NO2– (aq) panas N2(g) + 2H2O(l)
2. Secara komersil diperoleh dari distilasi bertingkat terhadap udara (proses linde dan claude).
3. Di laboratorium dari dekomposisi termal senyawa amonium nitrit CNH4NO2 dengan cara dipanaskan. Reaksinya seperti berikut :
CNH4NO2(s) → N2(g) + 2 H2O(l)
4. Dalam industri, dengan cara destruksi bertingkat dan pencairan (destilasi udaracair) karena N2 mempunyai titik didih rendah daripada O2 maka ia lebih dahulu menguap sebagai fraksi pertama
5. Secara spektroskop N2 murni di buat dengan dekomposisi termal NatriumBarium Azida. Berikut reaksinya:
NaN3 → 2 Na + 3 N2
6. Pemanasan NH4NO2 melalui reaksi sebagai berikut :
NH4NO2 → N2 + 2 H2O
7. Oksidasi NH3 melalui reaksi sebagai berikut :
2 NH3 + 3CuO → N2 + 3Cu + 3H2O
8. Destilasi (penyulingan ) bertingkat dari udara cair.
IKATAN NITROGEN
a. Ikatan Tunggal
Nitrogen dengan tiga ikatan tunggal terdapat dalam senyawa NR3 (R=H, alkali) yang mempunyai bentuk piramida segitiga. Terjadinya ikatan dapat diterangkan melalui orbital hibrida sp3 dengan pasangan elektron non ikatan atau pasangan elektron menyendiri menempati posisi salah satu dari keempat sudut struktur tetrahedron, dengan demikian bentuk molekul yang sesungguhnya menjadi tampak sebagai piramida segitiga. Aspek kimiawi yang penting dalam senyawa ini berkaitan denga peran pasangan elektron non ikatan. Dengan adanya sepasang electron non ikatan, semua senyawa NR3 bertindak sebagai basa Lewis. Oleh karena itu NR3 dapat membentuk senyawa kompleks dengan asam lewis dan dapat pula bertindak sebagai ligan ion-ion logam transisi.
Energi ikatan tunggal N-N relatif sangat lemah. Jika dibandingkan dengan energi ikatan tunggal C-C, terdapat perbedaan yang sangat mencolok. Perbandingan ini untuk unsur-unsur dalm periode 2 adalah 350, 160, 140, dan 150 kJ mol-1 , yang secara berurutan menunjuk pada energi ikatan tunggal dalam senyawa H3C-CH3, H2N-NH2, HO-OH, dan F-F. Perbedaan ini mungkin ada hubungannya dengan pengaruh tolakan antar pasangan elektron non ikatan, yaitu tidak ada, ada sepasang, dua pasang dan tiga pasang untuk masing-masing senyawa tersebut. Rendahnya energi ikatan tunggal ini, tidak seperti karbon, berakibat kecilnya kecenderungan pembentukan rantai bagi atom nitrogen.
b. Ikatan ganda / rangkap
Nitrogen membentuk molekul N2 yang stabil dengan ikatan ganda tiga yang sangat kuat dengan jarak ikatan sangat pendek yaitu 1,09 A. Energi ikatnya sangat besar, 942 kJ mol-1, jauh lebih besar daripada energy ikatan ganda tiga untuk fosfor (481 kJ mol-1) dan juga lebih besar daripada energy ikatan ganda tiga karbon (835 kJ mol-1). Hal ini dapat dijelaskan bahwa atom nitrogen menggunakan salah satu orbital p untuk ikatan ∞ dan dua yang lain untuk ikatan π. Fosfor membentuk molekul P4 atau struktur lapis tertentu dengan ikatan tunggal. Jika nitrogen membentuk satu ikatan tunggal dan satu ikatan rangkap dua, maka struktur molekulnya non linear.
c. Absennya peran orbital d
Dengan fluorin, nitrogen hanya membentuk trifluorida, NF3, sedangkan fosfor membentuk trifluorida PF3 dan pentafluorida PF5. teori hibridisasi menyarankan bahwa atom fosfor dalam PF5 mengalami hibridisasi sp3d, jadi melibatkan orbital 3d dalam membentuk ikatan P-F; atom nitrogen tidak mungkin menyediakan orbital d, dan oleh karena itu tidak mampu membentuk senyawa analog.
d. Elektronegatifitas
Elektronegatifitas nitrogen jauh lebih tinggi dibanding dengan anggota-anggota lainnya dalam golongannya. Akibatnya, sifat polaritas ikatan dalam senyawa nitrogen sering berlawanan dengan sifat polaritas ikatan dalam senyawa anggota lainnya. Ikatan kovalen N-H sangat polar maka ammonia bersifat basa, sedangkan senyawa hidrida anggota yang lain, fosfina PH3, arsina AsH3, dan stibina SbH3, bersifat netral.
SENYAWA SENYAWA NITROGEN
A. Amonia(NH3)
Amonia (NH3) dan garam-garamnya bersifat mudah larut dalam air. Sumber amonia di perairan adalah pemecahan nitrogen organik (protein dan urea) dan nitrogen anorganik yang terdapat di dalam tanah dan air, yang berasal dari dekomposisi bahan organic oleh mikroba dan jamur (amonifikasi). Sumber amonia adalah reduksi gas nitrogen yang berasal dari proses difusi udara atmosfer, limbah industri dan domestik. Amonia yang terdapat dalam mineral masuk ke badan air melalui erosi tanah. Selain terdapat dalam bentuk gas, amonia membentuk senyawa kompleks dengan beberapa ion logam. Amonia juga dapat terserap kedalam bahan-bahan tersuspensi dan koloid sehingga mengendap di dasar perairan. Amonia di perairan dapat menghilang melalui proses volatilisasi karena tekanan parsial amonia dalam larutan meningkat dengan semakin meningkatnya pH. Ikan tidak bisa bertoleransi terhadap kadar amonia bebas yang terlalu tinggi karena dapat mengganggu proses pengikatan oksigen oleh darah dan pada akhirnya dapat meningkatkan sifokasi. Pada budidaya intensif, yang padat penebaran tinggi dan pemberian pakan sangat intensif, penimbunan limbah kotoran terjadi sangat cepat.
Ammonia adalah bahan kimia dengan rumus kimia NH3. Molekul ammonia mempunyai bentuk segi tiga. Ammonia terdapat di atmosfera dalam kuantiti yang kecil akibat pereputan bahan organik. Ammonia juga dijumpai di dalam tanah, dan di tempat dekat dengan gunung berapi. Pada suhu dan tekanan piawai, ammonia adalah gas yang tidak mempunyai warna dan lebih ringan daripada udara (0.589 ketumpatan udara). Titik leburnya ialah -75 °C dan titik didihnya ialah -33.7 °C. 10% larutan ammonia dalam air mempunyai pH 12. Ammonia dalam bentuk cair mempunyai muatan haba yang sangat tinggi.
Dalam molekul amonia atom pusat N dikelilingi oleh tiga PEI dan sepasang PEB, maka bentuk molekul amonia adalah piramida segitiga; atom N terletak pada puncak piramida sedangkan ketiga atom H pada dasar piramida.
Pembuatan Amonia dengan Proses Haber Bosch
Dasar teori pembuatan amonia dari nitrogen dan hydrogen ditemukan oleh Fritz Haber (1908), seorang ahli kimia dari Jerman. Sedangkan proses industri pembuatan amonia untuk produksi secara besar-besaran ditemukan oleh Carl Bosch, seorang insinyur kimia juga dari Jerman. Persamaan termokimia reaksi sintesis amonia adalah :
N2(g) + 3H2(g) ⇄ 2NH3(g) ∆H = -92,4Kj Pada 25oC : Kp = 6,2×105
Berdasarkan prinsip kesetimbangan kondisi yang menguntungkan untuk ketuntasan reaksi ke kanan (pembentukanNH3) adalah suhu rendah dan tekanan tinggi. Akan tetapi, reaksi tersebut berlangsung sangat lambat pada suhu rendah, bahkan pada suhu 500oC sekalipun. Dipihak lain, karena reaksi ke kanan eksoterm, penambahan suhu akan mengurangi rendemen. Proses Haber-Bosch semula dilangsungkan pada suhu sekitar 500oC dan tekanan sekitar 150-350 atm dengan katalisator, yaitu serbuk besi dicampur dengan Al2O3, MgO, CaO, dan K2O.
Reaksi kekanan pada pembuatan amonia adalah reaksi eksoterm. Reaksi eksoterm lebih baik jika suhu diturunkan, tetapi jika suhu diturunkan maka reaksi berjalan sangat lambat . Amonia punya berat molekul 17,03. Amonia ditekanan atmosfer fasanya gas. Titik didih Amonia -33,35 oC, titik bekunya -77,7 oC, temperatur & tekanan kritiknya 133 oC & 1657 psi. Entalpi pembentukan (∆H), kkal/mol NH3(g) pada 0oC, -9,368; 25 oC, -11,04. Pada proses sintesis pd suhu 700-1000oF, akan dilepaskan panas sebesar 13 kkal/mol. Kondisi optimum untuk dapat bereaksi dengan suhu 400- 600oC, dengan tekanan 150-300 atm. Kondisi optimum pembuatan amonia (NH3) dapat digambarkan pada tabel berikut :
Tabel : Kondisi Optimum Pembuatan NH3
|
No
|
Faktor
|
Reaksi : N2(g) + 3H2(g) ⇄ 2NH3(g) ∆H= -924 kJ |
Kondisi Optimum
|
|
1.
|
Suhu
|
1. Reaksi bersifat eksoterm2. Suhu rendah akan menggeser kesetimbangan kekanan.3. Kendala:Reaksi berjalan lambat |
400-600oC
|
|
2.
|
Tekanan
|
1. Jumlah mol pereaksi lebih besar dibanding dengan jumlah mol produk.2. Memperbesar tekanan akan menggeser kesetimbangan kekanan.3. Kendala Tekanan sistem dibatasi oleh kemampuan alat dan faktor keselamatan. |
150-300 atm
|
|
3.
|
Konsentrasi
|
Pengambilan NH3 secara terus menerus akan menggeser kesetimbangan kearah kanan |
_
|
|
4.
|
Katalis
|
Katalis tidak menggeser kesetimbangan kekanan, tetapi mempercepat laju reaksi secara keseluruhan |
Fe dengan campuran Al2O3 KOH dan garam lainnya |
Pengaruh katalis pada sistem kesetimbangan adalah dapat mempercepat terjadinya reaksi kekanan atau kekiri, keadaan kesetimbangan akan tercapai lebih cepat tetapi katalis tidak mengubah jumlah kesetimbangan dari spesies-spesies yang bereaksi atau dengan kata lain katalis tidak mengubah nilai numeris dalam tetapan kesetimbangan. Peranan katalis adalah mengubah mekanisme reaksi kimia agar cepat tercapai suatu produk.
Katalis yang dipergunakan untuk mempercepat reaksi memberikan mekanisme suatu reaksi yang lebih rendah dibandingkan reaksi yang tanpa katalis. Dengan energi aktivasi lebih rendah menyebabkan maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan energi aktivasi sehingga jumlah tumbukan efektif akan bertambah sehingga laju meningkat. Perbandingan reaksi dengan katalis dan tanpa katalis dapat dilihat pada gambar dihalaman berikut:
Gambar : Perbandingan mekanisme reaksi menggunakan katalis dan tanpa katalis
Dengan kemajuan teknologi sekarang digunakan tekanan yang jauh lebih besar, bahkan mencapai 700 atm. Untuk mengurangi reaksi balik, maka amonia yang terbentuk segera dipisahkan. Mula-mula campuran gas nitrogen dan hidrogen dikompresi (dimampatkan) hingga mencapai tekanan yang diinginkan. Kemudian campuran gas dipanaskan dalam suatu ruangan yang bersama katalisator sehingga terbentuk amonia. Diagram alur dari proses Haber-bosch untuk sintesis amonia, diberikan pada Gambar berikut ini :
Di laboratorium dibuat dengan cara memanaskan campuran garam ammonium dengan suatu basa
NH4+(aq) + OH–(aq) à H2O(l) + NH3(g)
Contoh :
2NH4Cl(s) + Ca(OH)2(s) à CaCl (s) + 2H2O(l) + 2NH3(g)
Hidrolisis nitride ionic
Contoh :
Li3N + 3H2O à 3LiOH + NH3
Ca3N2 + 3H2O à 3Ca(OH)2 + 2N
Di industri : amoniak diperoleh dengan mereaksikan campuran gas N2 dan H2 pada suhu 500 oC, 200 atm < P < 1000 atm, katalis Fe.
N2(g) + 3H2(g) à 2NH3(g)
N2 diperoleh dari destilasi udara.
H2 diperoleh dari reaksi gas metan dan air.
CH4(s) + 2H2O(l) Ni CO2(g) + 4H2(g)
Apabila terdapat CO katalis akan terganggu kinerjanya dengan ditambahkan air.
CO(g) + H2O(l) à CO2(g) + H2(g)
Dimanfaatkan dalam industri pupuk kimia dasar untuk mensintesis HNO3, NH4NO3, NaHCO3, KNO3, HCN, (NH4)2SO4 dll.
B. Hidrazin (NH2-NH2)
Hidrazin dalam larutan air dibuat dari reaksi amonia dengan hipoklorit,dan diduga terjadi menurut dua tahap reaksi:
NH3 +OCl– à NH2Cl + OH–
NH2Cl + OH– à NH3 N2H4 + Cl– + H2O
Reaksi keseluruhan :
2 NH3 + OCl‑ àN2H4 + Cl– + H2O
Dalam suasana asam maupun basa, hidrazin bersifat sebagai pereduksi kuat, banyak digunakan sebagai pereduksi komponen bahan bakar roket dalm bentuk dimetil hidrazin, (CH3)2NNH2. Oksidasi hidrazin menghasilkan berbgai macam senyawa bergantung pada jenis oksidatornya. Struktur hidrazin mirip dengan struktur etana kecuali dalam hal salah atu atom H dari tiap gugus metilnya diganti dengan sepasang electron menyendiri, struktur ini mempunyai panjang ikatan tunggal N-N, 145 pm.
C. Nitrida
Nitrida adalah senyawa metal N. Secara umum apabila metal amida dipanaskan akan terjasdi deamoniasi menjadi metal nitrida misalnya seperti pada reaksi berikut :
3 Mg(NH2)2 à Mg3N2 + 4NH3
Metode yang lebih baik untuk pembutan nitride adalah pemanasan logam atau campuran oksida logam dan karbon dengan nitrogen atau ammonia.
D. Nitrogen Halida,NX3
Senyawa nitrogen florida yang terkenal adalah NF3 yang berupa gas tak berbau,tak berwarna dan tidak reaktif,yang dapat dibuat dari elektrolisis leburan amonium biflorida atau larutanya dalam anhidrat hidrogen florida. Senyawa ini mirip dengan ammonia, mempunyai satu pasanga electron menyendiri namun bersifat basa Lewis lemah.
E. Asam hidrozoik atau hidrogen azida,(HN3)
Asam ini dalam larutan air dapat diperoleh dari oksidasi hidrazin dengan asam nitrit menurut persamaan reaksi :
N2H4 + HNO2à HN3 + 2 H2O
Asam hidrozoik berupa cairan tak berwarna mendidih pada 370C dan membeku pada -800C, memberikan bau yang menyakitkan dan sangat beracun. Ion azida dimanfaatkan untuk bahan penyelamat dalam bentuk kantung gas dalam mobil. Untuk menghindari sentuhan pengendara dengan logam natrium dicampurkan Fe2O3.
F. Oksida Nitrogen dan Asam Oksi
Nitrogen dapat bersenyawa dengan oksigen membentuk oksida dengan berbagai tingkat oksidasi,dari +1 hingga +5, misalnya N2O, NO, N2O3, N2O4, NO2 dan N2O5. Sedangkan asam oksi nitrogen yang dapat ditemui adalah H2N2O2 (as.hiponitrit), HNO2 (as.nitrit), HNO3 (as.nitrat) dan HNO4 (as.peroksinitrit).
Dinitrogen monoksida, N2O. Oksida monovalen nitrogen. Pirolisis amonium nitrat akan menghasilkan oksida ini melalui reaksi:
NH4NO3 → N2O + 2 H2O (pemanasan pada 250° C).
Walaupun bilangan oksidasi hanya formalitas, merupakan hal yang menarik dan simbolik bagaimana bilangan oksidasi nitrogen berubah dalam NH4NO3 membentuk monovalen nitrogen oksida (+1 adalah rata-rata dari -3 dan +5 bilangan oksidasi N dalam NH4+ dan NO3–). Jarak ikatan N-N-O dalam N2O adalah 112 pm (N-N) dan 118 pm (N-O), masing-masing berkaitan dengan orde ikatan 2.5 dan 1.5. N2O (16e) isoelektronik dengan CO2 (16 e). Senyawa ini digunakan secara meluas untuk analgesik.
Nitrogen oksida, NO. Oksida divalen nitrogen. Didapatkan dengan reduksi nitrit melalui reaksi berikut:
KNO2 + KI + H2SO4 → NO + K2SO4 + H2O + ½ I2
Karena jumlah elektron valensinya ganjil (11 e), NO bersifat paramagnetik. Jarak N-O adalah 115 pm dan mempunyai karakter ikatan rangkap. Elektron tak berpasangan di orbital π* antiikatan dengan mudah dikeluarkan, dan NO menjadi NO+ (nitrosonium) yang isoelektronik dengan CO.
Karena elektronnya dikeluarkan dari orbital antiikatan, ikatan N-O menjadi lebih kuat. Senyawa NOBF4 dan NOHSO4 mengandung kation ini dan digunakan sebagai oksidator 1 elektron.
Walaupun NO sebagai gas monomerik bersifat paramagnetik, dimerisasi pada fasa padatnya akan menghasilkan diamagnetisme. NO merupakan ligan kompleks logam transisi yang unik dan membentuk kompleks misalnya [Fe(CO2)(NO)2], dengan NO adalah ligan netral dengan 3 elektron. Walaupun M-N-O ikatannya lurus dalam kompleks jenis ini, sudut ikatan M-N-O berbelok menjadi 120° – 140° dalam [Co(NH3)5(NO)]Br2, dengan NO– adalah ligan 4 elektron. Akhir-akhir ini semakin jelas bahwa NO memiliki berbagai fungsi kontrol biologis, seperti aksi penurunan tekanan darah, dan merupakan spesi yang paling penting, setelah ion Ca2+, dalam transduksi sinyal.
Dinitrogen trioksida, N2O3. Bilangan oksidasi nitrogen dalam senyawa ini adalah +3, senyawa ini tidak stabil dan akan terdekomposisi menjadi NO dan NO2 di suhu kamar. Senyawa ini dihasilkan bila kuantitas ekuivalen NO dan NO2 dikondensasikan pada suhu rendah. Padatannya berwarna biru muda, dan akan bewarna biru tua bila dalam cairan, tetapi warnanya akan memudar pada suhu yang lebih tinggi.
Nitrogen dioksida, NO2, merupakan senyawa nitrogen dengan nitrogen berbilangan oksidasi +4. NO2 merupakan senyawa dengan jumlah elektron ganjil dengan elektron yang tidak berpasangan, dan berwarna coklat kemerahan. Senyawa ini berada dalam kesetimbangan dengan dimer dinitrogen tetraoksida, N2O4, yang tidak bewarna. Proporsi NO2 adalah 0.01% pada -11° C dan meningkat perlahan menjadi 15,9% pada titik didihnya (21.2° C), menjadi 100% pada 140° C. N2O4 dapat dihasilkan dengan pirolisis timbal nitrat.
2 Pb(NO3)2 → 4NO2 + 2PbO + O2 pada 400 oC
Bila NO2 dilarutkan dalam air dihasilkan asam nitrat dan nitrit:
2 NO2 + H2O → HNO3 + HNO2
Dengan oksidasi satu elektron, NO2+ (nitroil) terbentuk dan sudut ikatan berubah dari 134o dalam NO2 netral menjadi 180o. Di pihak lain, dengan reduksi satu elektron, terbentuk ion NO2– (nitrito) dengan sudut ikatan 115o.
Dinitrogen pentoksida, N2O5, didapatkan bila asam nitrat pekat secara perlahan didehidrasi dengan fosfor pentoksida pada suhu rendah. Senyawa ini menyublim pada suhu 32.4o C. Karenadengan melarutkannya dalam air akan dihasilkan asam nitrat, dinitrogen pentoksida juga disebut asam nitrat anhidrat
.
N2O5 + H2O → 2 HNO3
Walaupun pada keadaan padat dinitrogen pentoksida merupakan pasangan ion NO2NO3 dengan secara bergantian lokasi ion ditempati oleh ion lurus NO2+ dan ion planar NO3–, pada keadaan gas molekul ini adalah molekular.
Oksida nitrogen
Berbagai oksida nitrogen akan dibahas dari yang berbilangan oksidasi rendah ke yang berbilangan oksidasi tinggi.
Dinitrogen monoksida, N2O. Oksida monovalen nitrogen. Pirolisis amonium nitrat akan menghasilkan oksida ini melalui reaksi:
NH4NO3 → N2O + 2 H2O (pemanasan pada 250° C).
Walaupun bilangan oksidasi hanya formalitas, merupakan hal yang menarik dan simbolik bagaimana bilangan oksidasi nitrogen berubah dalam NH4NO3 membentuk monovalen nitrogen oksida (+1 adalah rata-rata dari -3 dan +5 bilangan oksidasi N dalam NH4+ dan NO3–). Jarak ikatan N-N-O dalam N2O adalah 112 pm (N-N) dan 118 pm (N-O), masing-masing berkaitan dengan orde ikatan 2.5 dan 1.5. N2O (16e) isoelektronik dengan CO2 (16 e). Senyawa ini digunakan secara meluas untuk analgesik.
A. Nitrogen oksida, ( NO ).
Oksida divalen nitrogen. Didapatkan dengan reduksi nitrit melalui reaksi berikut:
KNO2 + KI + H2SO4 → NO + K2SO4 + H2O + ½ I2
Karena jumlah elektron valensinya ganjil (11 e), NO bersifat paramagnetik. Jarak N-O adalah 115 pm dan mempunyai karakter ikatan rangkap. Elektron tak berpasangan di orbital π* antiikatan dengan mudah dikeluarkan, dan NO menjadi NO+ (nitrosonium) yang isoelektronik dengan CO.
Karena elektronnya dikeluarkan dari orbital antiikatan, ikatan N-O menjadi lebih kuat. Senyawa NOBF4 dan NOHSO4 mengandung kation ini dan digunakan sebagai oksidator 1 elektron.
Walaupun NO sebagai gas monomerik bersifat paramagnetik, dimerisasi pada fasa padatnya akan menghasilkan diamagnetisme. NO merupakan ligan kompleks logam transisi yang unik dan membentuk kompleks misalnya [Fe(CO2)(NO)2], dengan NO adalah ligan netral dengan 3 elektron. Walaupun M-N-O ikatannya lurus dalam kompleks jenis ini, sudut ikatan M-N-O berbelok menjadi 120° – 140° dalam [Co(NH3)5(NO)]Br2, dengan NO– adalah ligan 4 elektron. Akhir-akhir ini semakin jelas bahwa NO memiliki berbagai fungsi kontrol biologis, seperti aksi penurunan tekanan darah, dan merupakan spesi yang paling penting, setelah ion Ca2+, dalam transduksi sinyal.
B. Dinitrogen trioksida, N2O3.
Bilangan oksidasi nitrogen dalam senyawa ini adalah +3, senyawa ini tidak stabil dan akan terdekomposisi menjadi NO dan NO2 di suhu kamar. Senyawa ini dihasilkan bila kuantitas ekuivalen NO dan NO2 dikondensasikan pada suhu rendah. Padatannya berwarna biru muda, dan akan bewarna biru tua bila dalam cairan, tetapi warnanya akan memudar pada suhu yang lebih tinggi.
C. Nitrogen dioksida ( NO2)
Nitrogen dioksida merupakan senyawa nitrogen dengan nitrogen berbilangan oksidasi +4. NO2 merupakan senyawa dengan jumlah elektron ganjil dengan elektron yang tidak berpasangan, dan berwarna coklat kemerahan. Senyawa ini berada dalam kesetimbangan dengan dimer dinitrogen tetraoksida, N2O4, yang tidak bewarna. Proporsi NO2 adalah 0.01% pada -11° C dan meningkat perlahan menjadi 15,9% pada titik didihnya (21.2° C), menjadi 100% pada 140° C.
N2O4 dapat dihasilkan dengan pirolisis timbal nitrat
2 Pb(NO3)2 → 4NO2 + 2PbO+O2 pada 400 oC
Bila NO2 dilarutkan dalam air dihasilkan asam nitrat dan nitrit:
2 NO2 + H2O → HNO3+HNO2
Dengan oksidasi satu elektron, NO2+ (nitroil) terbentuk dan sudut ikatan berubah dari 134o dalam NO2 netral menjadi 180o. Di pihak lain, dengan reduksi satu elektron, terbentuk ion NO2– (nitrito) dengan sudut ikatan 115o.
D. Dinitrogen pentaoksida ( N2O5)
Dinitrogen pentaoksida didapatkan bila asam nitrat pekat secara perlahan didehidrasi dengan fosfor pentoksida pada suhu rendah. Senyawa ini menyublim pada suhu 32.4oC. Karena dengan melarutkannya dalam air akan dihasilkan asam nitrat, dinitrogen pentoksida juga disebut asam nitrat anhidrat.
N2O5 + H2O → 2 HNO3
Walaupun pada keadaan padat dinitrogen pentoksida merupakan pasangan ion NO2NO3 dengan secara bergantian lokasi ion ditempati oleh ion lurus NO2+ dan ion planar NO3–, pada keadaan gas molekul ini adalah molekular.
E. Asam nitrat (HNO3)
Secara komersil asam nitrat dibuat dengan cara oksidasi amoniak. Prosesnya disebut dengan Proses Oswald. Tahapannya sebagai berikut :
1. Oksidasi ammonia menjadi NO menggunakan katalis campuran logam platinum – radium yang dipanaskan hingga 900 oC.
4NH3 + 5O2 katalis 4NO + 6H2O
Pada kondisi ini 97% ammonia diubah menjadi NO.
2. NO direaksikan dengan oksigen membentuk NO2
2NO + O2 à 2NO2
Kecepatan reaksi oksidasi ini menurun dengan naiknya suhu sehingga suhu dipertahankan 25 oC dengan menggunakan pendingin air.
3. Absorpsi NO2 oleh air
3NO2 + H2O à 2HNO3 + NO
Catatan :
Ø NO yang dihasilkan didaur ulang untuk oksidasi menjadi NO2.
Ø HNO3 (dalam air) yang dihasilkan kadarnya 50%, dapat ditingkatkan menjadi 68% dengan destilasi.
Asam nitrat merupakan zat cair tidak berwarna, berasap (titik didih 83 oC) dengan bau yang tajam. HNO3 terdekomposisi oleh cahaya matahari.
4HNO3(aq) à 4NO2(g) + 2H2O(l) + O2(g)
Karena dekomposisi ini, warna HNO3 berubah menjadi kuning setelah disimpan lama karena terbentuk NO2 yang melarut.
HNO3 pekat konsentrasinya 15,9 M (70,4%) dan merupakan pengoksidasi kuat. Asam nitrat digunakan dalam industry pupuk, sistem pendorong roket dengan bahan bakar cair dan lain – lain :
Ø Pupuk : NH4NO3, NaNO3, Ca(NO3)2, KNO3, Co(NO3)2
Ø Bahan peledak : NH4NO3, NaNO3, Ca(NO3)2, KNO3, Ba(NO3)2
Ø Kembang api : NH4NO3, NaNO3, Ca(NO3)2, KNO3, Ba(NO3)2, Sr(NO3)2, Mg(NO3)2
Ø Pengawet makanan : NaNO3, KNO3
Ø Germisida, fungisida, insektisida : NH4NO3, AgNO3, Ba(NO3)2, Cu(NO3)2
Ø Cat rambut : AgNO3, Co(NO3)2
Ø Korek api : NaNO3, KNO3, Ca(NO3)2, Sr(NO3)2, Pb(NO3)2
Ø Produk medis : NaNO3, KNO3, Cu(NO3)2, Sr(NO3)2, Fe(NO3)2, Zn(NO3)2, AgNO3, Hg2(NO3)2, Hg(NO3)2
F. Urea CO(NH2)2
Ø Pupuk urea mengandung kurang lebih 46% N sehingga digunakan sebagai sumber nitrogen bagi tumbuh – tumbuhan.
Ø Di dalm tanah, urea bersifat basa.
Ø Bahan baku pembuatan urea adalah gas alam dan udara.
CH4(g) + 2H2O(l) Ni CO2(g) + 4H2(g)
N2(g) + 3H2(g) à 2NH3(g) (proses haber dosh)
Ø Urea dapat digunakan untuk membuat sejenis plastik ureaformaldehyde
G. Natrium nitrit (NaNO2)
Digunakan untuk :
Ø Pembuatan zat warna
Ø Bahan farmasi
Ø Dalam industry teksit sebagai zat pemutih
Ø Pada makanan untuk menambah cita rasa, memberikan warna merah pada daging dan mencegah pertumbuhan bakteri clostrodium botolinum.
Efek negatif nitrit terhadap makanan :
Ø Nitrit mengoksidasi hemoglobin menjadi methahemoglobin (Fe2+ dioksidasi menjadi Fe3+) sehingga daya angkut O2 berkurang dan menimbulkan keracunan seperti saat menghirup gas CO.
Ø Asam nitrit dan amina sekunder membentuk nitrosiamin bersifat karsinogenik menyebabkan kanker.
SIKLUS NITROGEN
- Proses – Proses dalam Daur Nitrogen

Nitrogen hadir di lingkungan dalam berbagai bentuk kimia termasuk nitrogen organik, amonium (NH4 +), nitrit (NO2–), nitrat (NO3–), dan gas nitrogen (N2). Nitrogen organik dapat berupa organisme hidup, atau humus, dan dalam produk antara dekomposisi bahan organik atau humus dibangun. Proses siklus nitrogen mengubah nitrogen dari satu bentuk kimia lain. Banyak proses yang dilakukan oleh mikroba baik untuk menghasilkan energi atau menumpuk nitrogen dalam bentuk yang dibutuhkan untuk pertumbuhan. Diagram di atas menunjukkan bagaimana proses-proses cocok bersama untuk membentuk siklus nitrogen (lihat gambar).
1. Fiksasi Nitrogen
Fiksasi nitrogen adalah proses alam, biologis atau abiotik yang mengubah nitrogen di udara menjadi ammonia (NH3). Mikroorganisme yang mem-fiksasi nitrogen disebut diazotrof. Mikroorganisme ini memiliki enzim nitrogenaze yang dapat menggabungkan hidrogen dan nitrogen. Reaksi untuk fiksasi nitrogen biologis ini dapat ditulis sebagai berikut :
N2 + 8 H+ + 8 e− → 2 NH3 + H2
Mikro organisme yang melakukan fiksasi nitrogen antara lain : Cyanobacteria, Azotobacteraceae, Rhizobia, Clostridium, dan Frankia. Selain itu ganggang hijau biru juga dapat memfiksasi nitrogen. Beberapa tanaman yang lebih tinggi, dan beberapa hewan (rayap), telah membentuk asosiasi (simbiosis) dengan diazotrof. Selain dilakukan oleh mikroorganisme, fiksasi nitrogen juga terjadi pada proses non-biologis, contohnya sambaran petir. Lebih jauh, ada empat cara yang dapat mengkonversi unsur nitrogen di atmosfer menjadi bentuk yang lebih reaktif :
a. Fiksasi biologis
Beberapa bakteri simbiotik (paling sering dikaitkan dengan tanaman polongan) dan beberapa bakteri yang hidup bebas dapat memperbaiki nitrogen sebagai nitrogen organik. Sebuah contoh dari bakteri pengikat nitrogen adalah bakteri Rhizobium mutualistik, yang hidup dalam nodul akar kacang-kacangan. Spesies ini diazotrophs. Sebuah contoh dari hidup bebas bakteri Azotobacter.
b. Industri fiksasi nitrogen
Di bawah tekanan besar, pada suhu 600 C, dan dengan penggunaan katalis besi, nitrogen atmosfer dan hidrogen (biasanya berasal dari gas alam atau minyak bumi) dapat dikombinasikan untuk membentuk amonia (NH3). Dalam proses Haber-Bosch, N2 adalah diubah bersamaan dengan gas hidrogen (H2) menjadi amonia (NH3), yang digunakan untuk membuat pupuk dan bahan peledak.
c. Pembakaran bahan bakar fosil
Mesin mobil dan pembangkit listrik termal, yang melepaskan berbagai nitrogen oksida (NOx).
d. Proses lain
Selain itu, pembentukan NO dari N2 dan O2 karena foton dan terutama petir, dapat memfiksasi nitrogen.
2. Asimilasi
Tanaman mendapatkan nitrogen dari tanah melalui absorbsi akar baik dalam bentuk ion nitrat atau ion amonium. Sedangkan hewan memperoleh nitrogen dari tanaman yang mereka makan.
Tanaman dapat menyerap ion nitrat atau amonium dari tanah melalui rambut akarnya. Jika nitrat diserap, pertama-tama direduksi menjadi ion nitrit dan kemudian ion amonium untuk dimasukkan ke dalam asam amino, asam nukleat, dan klorofil. Pada tanaman yang memiliki hubungan mutualistik dengan rhizobia, nitrogen dapat berasimilasi dalam bentuk ion amonium langsung dari nodul. Hewan, jamur, dan organisme heterotrof lain mendapatkan nitrogen sebagai asam amino, nukleotida dan molekul organik kecil.
3. Amonifikasi
Jika tumbuhan atau hewan mati, nitrogen organik diubah menjadi amonium (NH4+) oleh bakteri dan jamur.
4. Nitrifikasi
Konversi amonium menjadi nitrat dilakukan terutama oleh bakteri yang hidup di dalam tanah dan bakteri nitrifikasi lainnya. Tahap utama nitrifikasi, bakteri nitrifikasi seperti spesies Nitrosomonas mengoksidasi amonium (NH4 +) dan mengubah amonia menjadi nitrit (NO2–). Spesies bakteri lain, seperti Nitrobacter, bertanggung jawab untuk oksidasi nitrit menjadi dari nitrat (NO3–). Proses konversi nitrit menjadi nitrat sangat penting karena nitrit merupakan racun bagi kehidupan tanaman.
Proses nitrifikasi dapat ditulis dengan reaksi berikut ini :
1. NH3 + CO2 + 1.5 O2 + Nitrosomonas → NO2– + H2O + H+
2. NO2– + CO2 + 0.5 O2 + Nitrobacter → NO3–
3. NH3 + O2 → NO2− + 3H+ + 2e−
4. NO2− + H2O → NO3− + 2H+ + 2e
note : “Karena kelarutannya yang sangat tinggi, nitrat dapat memasukkan air tanah. Peningkatan nitrat dalam air tanah merupakan masalah bagi air minum, karena nitrat dapat mengganggu tingkat oksigen darah pada bayi dan menyebabkan sindrom methemoglobinemia atau bayi biru. Ketika air tanah mengisi aliran sungai, nitrat yang memperkaya air tanah dapat berkontribusi untuk eutrofikasi, sebuah proses dimana populasi alga meledak, terutama populasi alga biru-hijau. Hal ini juga dapat menyebabkan kematian kehidupan akuatik karena permintaan yang berlebihan untuk oksigen. Meskipun tidak secara langsung beracun untuk ikan hidup (seperti amonia), nitrat dapat memiliki efek tidak langsung pada ikan jika berkontribusi untuk eutrofikasi ini.”
5. Denitrifikasi
Denitrifikasi adalah proses reduksi nitrat untuk kembali menjadi gas nitrogen (N2), untuk menyelesaikan siklus nitrogen. Proses ini dilakukan oleh spesies bakteri seperti Pseudomonas dan Clostridium dalam kondisi anaerobik. Mereka menggunakan nitrat sebagai akseptor elektron di tempat oksigen selama respirasi. Fakultatif anaerob bakteri ini juga dapat hidup dalam kondisi aerobik.
Denitrifikasi umumnya berlangsung melalui beberapa kombinasi dari bentuk peralihan sebagai berikut:
NO3− → NO2− → NO + N2O → N2
Proses denitrifikasi lengkap dapat dinyatakan sebagai reaksi redoks:
2 NO3− + 10 e− + 12 H+ → N2 + 6 H2O
6. Oksidasi Amonia Anaerobik
Dalam proses biologis, nitrit dan amonium dikonversi langsung ke elemen (N2) gas nitrogen. Proses ini membentuk sebagian besar dari konversi nitrogen unsur di lautan. Reduksi dalam kondisi anoxic juga dapat terjadi melalui proses yang disebut oksidasi amonia anaerobik
NH4+ + NO2− → N2 + 2 H2O
KEGUNAAN NITROGEN
o Dalam bentuk ammonia, nitrogen digunakan sebagai bahan pupuk, pembuatan pulp untuk kertas, pembuatan garam nitrat dan asam nitrat, berbagai jenis bahan peledak, pembuatan senyawa nitro dan berbagai jenis refrigeran. Dari gas ini juga dapat dibuat urea, hidrazina dan hidroksilamina.
o Asam nitrat digunakan dalam pembuatan zat pewarna dan bahan peledak.
o Nitrogen sering digunakan jika diperlukan lingkungan yang inert, misalnya dalam bola lampu listrik untuk mencegah evaporasi filamen .
o Sedangkan nitrogen cair banyak digunakan sebagai refrigerant (pendingin) yang sangat efektifkarena relatif murah.
o Banyak digunakan oleh laboratorium – laboratorium medis dan laboratorium – laboratorium penelitian sebagai pengawet bahan-bahan preservatif untuk jangka waktu yang sangat lama, misalnya pada bank sperma, bank penyimpanan organ-organ tubuh manusia, bank darah, dsb.
o Fungsi Dalam Ekologi
Nitrogen sangatlah penting untuk berbagai proses kehidupan di Bumi. Nitrogen adalah komponen utama dalam semua asam amino, yang nantinya dimasukkan ke dalam protein, tahu kan kalau protein adalah zat yang sangat kita butuhkan dalam pertumbuhan. Nitrogen juga hadir di basis pembentuk asam nukleat, seperti DNA dan RNA yang nantinya membawa hereditas. Pada tumbuhan, banyak dari nitrogen digunakan dalam molekul klorofil, yang penting untuk fotosintesis dan pertumbuhan lebih lanjut. Meskipun atmosfer bumi merupakan sumber berlimpah nitrogen, sebagian besar relatif tidak dapat digunakan oleh tanaman. Pengolahan kimia atau fiksasi alami (melalui proses konversi seperti yang dilakukan bakteri rhizobium), diperlukan untuk mengkonversi gas nitrogen menjadi bentuk yang dapat digunakan oleh organisme hidup, oleh karena itu nitrogen menjadi komponen penting dari produksi pangan. Kelimpahan atau kelangkaan dari bentuk “tetap” nitrogen, (juga dikenal sebagai nitrogen reaktif), menentukan berapa banyak makanan yang dapat tumbuh pada sebidang tanah
- 1. Oksigen

Sejarah
Selama beberapa abad, para ahli kadang-kadang menyadari bahwa udara terdiri lebih dari satu komponen. Sifat oksigen dan nitrogen sebagai komponen udara mengarah pada pengembangan teori flogiston pada proses pembakaran, yang sering terpikir oleh para ahli kimia selama satu abad. Oksigen telah dibuat oleh beberapa ahli, termasuk Bayen dan Borch, tetapi mereka tidak tahu cara mengumpulkannya. Mereka juga tidak mempelajari sifat-sifatnya dan tidak mengenali oksigen sebagai unsur dasar.
Seorang ahli bernama Priestley dipuji karena penemuannya, meski Scheele juga menemukan oksigen secara bebas.
Dulu, bobot atom oksigen digunakan sebagai standar pembanding untuk unsur yang lain, hingga pada tahun 1961, ketika IUPAC (International Union of Pure and Applied Chemistry) menggunakan atom karbon 12 sebagai standar pembanding yang baru.
Sumber
Oksigen adalah unsur ketiga terbanyak yang ditemukan berlimpah di matahari, dan memainkan peranan dalam siklus karbon-nitrogen, yahkni proses yang diduga menjadi sumber energi di matahari dan bintang-bintang. Oksigen dalam kondisi tereksitasi memberikan warna merah terang dan kuning-hijau pada Aurora Borealis.
Oksigen merupakan unsur gas, menyusun 21% volume atmosfer dan diperoleh dengan pencairan dan penyulingan bertingkat. Atmosfer Mars mengandung oksigen sekitar 0.15%. dalam bentuk unsur dan senyawa, oksigen mencapai kandungan 49.2% berat pada lapisan kerak bumi. Sekitar dua pertiga tubuh manusia dan sembilan persepuluh air adalah oksigen.
Di laboratorium, oksigen bisa dibuat dengan elektrolisis air atau dengan memanaskan KClO3 dengan MnO2 sebagai katalis.
Sifat-sifat
Oksigen tidak berbau, tidak berasa dan tidak berwarna. Dalam bentuk cair dan padat, oksigen berwarna biru pucat dan merupakan paramagnetik yang kuat.
Bentuk lain
Ozon (O3). Merupakan senyawa yang sangat aktif, dihasilkan dari pelepasan muatan elektris (kilat) atau penyinaran sinar Ultraviolet terhadap oksigen.
Keberadaan ozon di atmosfer (dengan jumlah yang sebanding dengan ketebalan lapisan 3 mm dengan kondisi tekanan dan suhu yang luar biasa) mencegah sinar Ultraviolet yang berbahaya dari matahari sebelum mencapai permukaan. Pencemaran udara di atmosfer dapat merusak lapisan ozon ini. Ozon bersifat racun dan tidak boleh terpapar dengan ozon melebihi kadar 0.2 mg/m# (8 jam kerja rata-rata-40 jam per minggu). Ozon yang masih pekat memiliki warna hitam kebiru-biruan dan ozon padat berwarna hitam ungu.
Senyawa
Oksigen, yang sangat reaktif, adalah komponen ratusan ribu senyawa organik dan dapat bergabung dengan kebanyakan unsur.
Kegunaan
Tanaman dan hewan sangat tergantung pada oksigen untuk bernafas. Rumah sakit sering menulis resep oksigen untuk pasien dengan penyakit pernafasan ringan.
Isotop
Oksigen memiliki 9 isotop. Oksigen alami adalah campuran dari 3 isotop
Oksigen berbobot aatom 18 yang terdapat di alam bersifat stabil dan tersedia untuk keperluan komersial, seperti dalam air (H2O dengan kandungan isotop 18 sebanyak 15%). Konsumsi oksigen komersial di Amerika Serikat diperkirakan mencapai 20 juta ton per tahun dan diperkirakan akan terus meningkat.
Penggunaan oksigen pada tungku peleburan baja merupakan penggunaan tertinggi. Jumlah yang banyak juga diperlukan pada proses pembuatan gas ammonia, metanol, etilen oksida dan pengelasan oksi-asetilen.
Pemisahan udara (destilasi) menghasilkan gas dengan kemurnian 99%, sedangkan elektrolisis hanya 1%
Siklus Oksigen
Oksigen adalah gas yang dibutuhkan makhluk hidup seperti misalnya manusia bernafas menghirup oksigen yang ada di udara dan selanjutnya masuk ke dalam sistem pernafasan.
Demikian juga tanaman yang melakukan pertukaran oksigen dengan makhluk hidup disekitarnya, juga pertukaran oksigen yang terjadi di atmosfer bumi. Melihat dari proses pertukaran oksigen tersebut, sebenarnya kita sudah dapat menyimpulkan apa itu pengertian siklus oksigen.

Jadi siklus oksigen adalah proses pertukaran oksigen di bumi ini yang berlangsung secara terus menerus tidak ada habisnya. Siklus oksigen terjadi karena semua makhluk hidup membutuhkan oksigen untuk kelangsungan hidupnya, dan kalau kita sudah mengetahui adanya siklus oksigen maka diharapkan untuk tidak mengganggu ekosistem lingkungan yang dapat mengacaukan siklus oksigen.
Misalnya dengan melakukan penebangan liar, maka hutan yang seharusnya menjadi media daur ulang oksigen yang bagus akan mulai gundul dan siklus oksigen tidak dapat terjadi dengan sempurna.